El pH
La abreviatura pH es la expresión latina "pondus Hydrogenii" y cuando se traduce tiene el significado base absoluta de hidrógeno.
Por lo tanto, el pH es una medida de la concentración de iones H3O+ (iones hidronio) en una sustancia.
Como resultado de esta concentración se pueden hacer conclusiones precisas del carácter ácido y neutro o alcalino (básico) de una sustancia.
El pH es un importante parámetro a medir en muchos procesos químicos y bioquímicos. Por ejemplo, el grado de madurez del queso y de la carne o el grado de acidez de la masa ácida y de los baños galvánicos.
El pH también juega un papel importante en las industrias farmacéuticas y medioambientales.
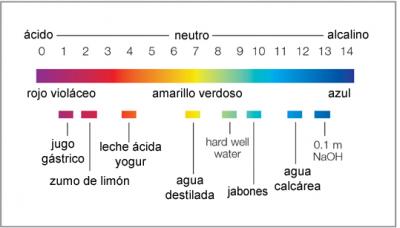
La escala de pH: Así pues, la escala de pH es una escala logarítmica decimal que va normalmente desde 0 (muy ácido) a 14 (muy alcalino). También se pueden encontrar pHs que son inferiores a 0 y superiores a 14 en ácidos o lejías con elevadas concentraciones. Si la sustancia tiene un pH 7, tiene un carácter neutro.
Cálculo del pH:
pH = -log [H+]
[H+] = Concentración de ión hidronio
Ejemplo:
Concentración de H+ = 10-4 mol/l es equivalente a un pH = 4
1 mol (cantidad de material) = 6.022x10^23 partículas

